双相缓释系统控制释放的药物缓释制剂及其制备方法与流程
 2021-01-08 11:01:55|
2021-01-08 11:01:55| 370|
370| 起点商标网
起点商标网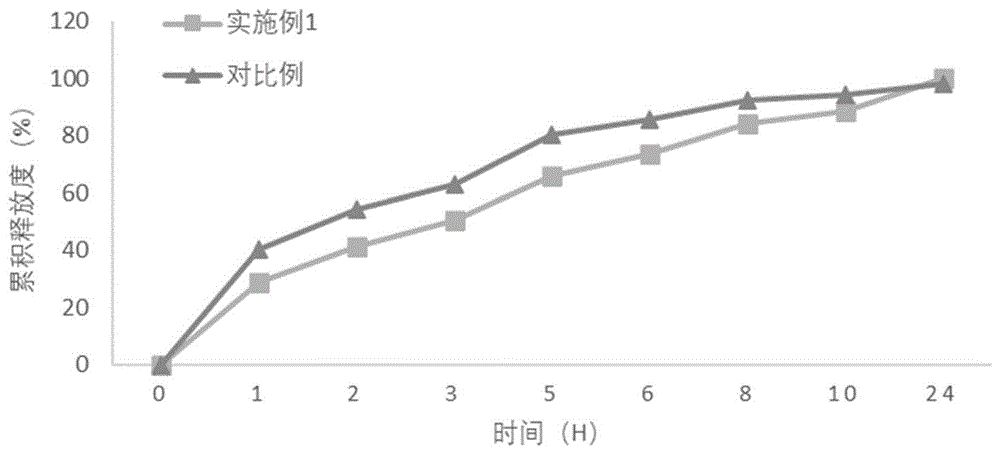
本发明涉及生物医药领域,具体地说,涉及一种双相缓释系统控制释放的药物缓释制剂及其制备方法。
背景技术:
药物的缓控释制剂技术包括缓释包衣控制药物释放,热熔挤出技术制备缓释制剂控制药物释放,缓释微囊(喷雾干燥)+缓释颗粒(干法制粒)控制药物释放,渗透泵技术控制药物释放等,上述制剂工艺较复杂,批量化生产成本相对较高。而骨架型缓释制剂制备工艺相对较简单,得到了广泛应用,但在实际应用中普遍存在前期突释和后期释放不完全的问题。因此,亟需开发新的药物缓释系统,以免药物即刻崩解和过早释放。
技术实现要素:
本发明针对普通缓释骨架片存在的问题,提供一种双相缓释系统控制释放的药物缓释制剂(“双相”缓释系统控制释放的骨架型缓释制剂)及其制备方法。采用“双相”缓释控制体系一定程度上可以控制缓释制剂前期、中期、后期释放,降低了缓释制剂前期突释和后期释放不完全的风险,更有利于患者的血药浓度稳定,以达到最佳的治疗效果。
本发明构思如下:提供一种多聚体成型的“双相”控制释放的骨架型缓释片剂的制备技术,包括:①原料与一种或多种控制药物释放的低粘度的亲水性多聚体物经湿法制粒后结合形成“内相”,为均匀的颗粒相,也可包含适量的致孔剂、助溶剂、吸附剂等;②将①所得的颗粒与控制药物释放的一种或多种高粘度亲水性多聚体物混合均匀后形成“外相”,也可包含适量的填充剂、润滑剂等,经压片工艺制得缓释制剂,该制剂遇水后为凝胶状,具有一定的粘性能够粘附在胃粘膜/粘液层上,延长胃停留时间,确保药物从胶状缓释片以弥散的方式缓慢平稳释放。
对于高水溶性药物,该技术“外相”部分需要大量的高粘度聚合物来延缓药物的释放,主要为扩散型缓释凝胶骨架片;对于低水溶性的药物,该技术“内相”颗粒部分需要加入适量的致孔剂、助溶剂,与“外相”的一种或多种高粘度聚合物控制药物释放,多为溶蚀型缓释凝胶骨架片。
为了实现本发明目的,第一方面,本发明提供一种双相缓释系统控制释放的药物缓释制剂,所述药物缓释制剂是先将活性药物与低粘度亲水性聚合物经湿法制粒形成内相缓释系统,再将内相缓释系统与高粘度亲水性聚合物混合后形成外相缓释系统,经压片工艺制成。
所述内相缓释系统还包含致孔剂、助溶剂、吸附剂、ph调节剂等中的至少一种。
所述外相缓释系统还包含填充剂、助流剂、润滑剂等中的至少一种。
所述低粘度亲水性聚合物可以选自黄原胶、羧甲基纤维素钠、pva(聚乙烯醇)、明胶、阿拉伯胶、羟丙基纤维素、低粘度hpmc(羟丙基甲基纤维素)等中的至少一种。
所述高粘度亲水性聚合物可以选自pvp(聚乙烯吡咯烷酮)、peg(聚乙二醇)、高粘度hpmc等中的至少一种。
所述致孔剂可以是微晶纤维素和/或乳糖等。
所述助溶剂可以是聚氧乙烯蓖麻油、十二烷基硫酸钠等。
所述吸附剂可以是二氧化硅和/或硅酸铝钠等。
所述ph调节剂可以是柠檬酸钠和/或磷酸氢钙等。
所述填充剂可以选自微晶纤维素、玉米淀粉、预胶化淀粉、蔗糖、无机盐、糖醇等中的至少一种。
所述助流剂可以是二氧化硅和/或滑石粉等。
所述润滑剂可以是硬脂酸镁和/或硬脂富马酸钠等。
优选地,所述内相缓释系统中活性药物与低粘度亲水性聚合物的质量比为2-10:1。
优选地,所述高粘度亲水性聚合物占药物缓释制剂的质量百分数为4%~45%。
优选地,所述致孔剂占药物缓释制剂的质量百分数为9%~20%。
优选地,所述助溶剂占药物缓释制剂的质量百分数为4.5%~15%。
优选地,所述吸附剂占药物缓释制剂的质量百分数为3%~7%。
优选地,所述ph调节剂占药物缓释制剂的质量百分数为5%~10%。
优选地,所述填充剂占药物缓释制剂的质量百分数为2%~15%。
优选地,所述助流剂占药物缓释制剂的质量百分数为2%~4%。
优选地,所述润滑剂占药物缓释制剂的质量百分数为0.4%~2%。
本发明中,所述低粘度hpmc可以是hpmce50和/或hpmce15lv等。
所述高粘度hpmc可以选自hpmce4m、hpmce10m、hpmck100m、hpmck15m等中的至少一种。
第二方面,本发明提供所述药物缓释制剂的制备方法,包括:
s1、将活性原料药粉碎后与低粘度亲水性聚合物按比例混合,湿法制粒,干燥后得到内相缓释系统;
s2、将内相缓释系统与高粘度亲水性聚合物按比例混合,压片。
第三方面,本发明提供扩散型缓释凝胶骨架片,所述扩散型缓释凝胶骨架片采用上述双相缓释系统控制释放的药物缓释制剂的制备方法制得,其中,所述活性原料药为高水溶性药物;所述高粘度亲水性聚合物占所述扩散型缓释凝胶骨架片的质量百分数为30%~45%。
优选地,所述高水溶性药物选自双胍类药物、丙戊酸钠等。
第四方面,本发明提供溶蚀型缓释凝胶骨架片,所述溶蚀型缓释凝胶骨架片采用上述双相缓释系统控制释放的药物缓释制剂的制备方法制得,其中,所述活性原料药为低水溶性药物;所述高粘度亲水性聚合物占所述溶蚀型缓释凝胶骨架片的质量百分数为4%~30%。
优选地,所述低水溶性药物选自非洛地平、富马酸喹硫平等。
在本发明的一个具体实施方式中,提供一种盐酸二甲双胍缓释制剂,所述盐酸二甲双胍缓释制剂包括如下重量份的各组分:盐酸二甲双胍5份、微晶纤维素0.7~2份、羧甲纤维素钠7hf0.3~0.7份、hpmck100m3~4份、hpmce5lv0.1~0.3份和硬脂酸镁0.1~0.3份。
所述盐酸二甲双胍缓释制剂的制备方法包括:
1)将粉碎后的原料药盐酸二甲双胍,与微晶纤维素和羧甲纤维素钠7hf按比例混合,加入润湿剂(纯化水或50~75%乙醇溶液)进行湿法制粒,干燥,控制颗粒水分含量在2%以内;
2)将步骤1)制得的颗粒与hpmck100m、hpmce5lv和硬脂酸镁混合均匀后压片。
优选地,步骤1)中干燥的温度为60℃~70℃。
在本发明的另一个具体实施方式中,提供一种非洛地平缓释制剂,所述非洛地平缓释制剂包括如下重量份的各组分:非洛地平0.1份、无水乳糖0.2~0.4份、羟丙基纤维素exf0.2~0.4份、二氧化硅0.04~0.06份、聚氧乙烯蓖麻油0.05~0.15份、hpmck100m0.05~0.15份、hpmce500.6~1.0份、微晶纤维素0.2~0.4份、二氧化硅0.05~0.15份和硬脂富马酸钠0.01~0.03份。
所述非洛地平缓释制剂的制备方法包括:
a)将粉碎后的原料药非洛地平、无水乳糖、羟丙基纤维素exf、聚氧乙烯蓖麻油和少量的二氧化硅混合,加入95%~100%乙醇溶液进行湿法制粒,干燥;
b)将步骤a)制得的颗粒与hpmck100m、hpmce50、微晶纤维素、硬脂富马酸钠和余量的二氧化硅混合均匀后压片。
优选地,步骤a)中干燥的温度为60℃~70℃。
借由上述技术方案,本发明至少具有下列优点及有益效果:
(一)本发明适用于绝大多数缓释制剂的制备,既可以解决大规格易溶性原料制成缓释口服制剂前期易突释的问题,又可以解决小规格难溶性原料制成缓释制剂后期释放不完全的问题,该工艺制得的缓释制剂为双层亲水的多聚体成型片系统(双相控制释放的缓释释放系统),经口服给药后24h内缓慢平稳释放,以利于维持平稳的血药浓度,减少患者的服药次数,提高患者的顺应性,延长服药间隔,有利于临床使用。
(二)本发明选用羧甲基纤维素钠、羟丙基纤维素等作为“内相”缓释材料,与活性药物成分(activepharmaceuticalingredient,api)、致孔剂、助溶剂等经湿法制粒工艺制成均匀颗粒,与“外相”缓释材料hpmc混合均匀,再加入适量填充剂、助流剂、润滑剂等混合,经压片工艺制成“双相”系统控制释放的骨架型缓释片,该制剂工艺相对于缓释包衣工艺、热熔挤出工艺、流化床制粒工艺+缓释包衣工艺简单易行,缩短生产周期,适合批量化生产。
(三)本工艺对制剂规格,药物活性成分的bcs分类无要求,适用于对湿热稳定的api制剂,包括但不限于扩散型缓释凝胶骨架片、溶蚀型缓释凝胶骨架片、扩散-溶蚀型缓释凝胶骨架片。
附图说明
图1为本发明较佳实施例中盐酸二甲双胍缓释片的体外释放曲线情况。
图2为本发明较佳实施例中按照本发明工艺制备的盐酸二甲双胍缓释片与cn1415288a中制备的二甲双胍缓释片的体外释放情况对比结果。
图3为本发明较佳实施例中非洛地平缓释片的体外释放曲线情况。
图4为本发明较佳实施例中采用不同型号的羟丙基甲基纤维素制得的非洛地平缓释片的体外释放曲线结果。
图5为本发明较佳实施例中非洛地平缓释片本专利的制备工艺与传统工艺所得成药体外释放情况对比结果。
图6为本发明较佳实施例中非洛地平缓释片与传统缓释片制备工艺的比较。
图7为本发明较佳实施例中本发明工艺与粉末直压工艺的比较。
图8为本发明较佳实施例中从非洛地平缓释片剂处方中去除致孔剂所得成药的缓释效果。
图9为本发明较佳实施例中富马酸喹硫平缓释片与传统工艺所得成药体外释放情况对比结果。
具体实施方式
本发明提供一种“双相”缓释系统控制释放的骨架型缓释制剂及其制备方法。主要步骤如下:
步骤1:原料的前处理。
对于易溶性原料药,根据原料的性质确定是否需要粉碎处理,粉碎至细粉级别,以改善颗粒的可压性,如盐酸二甲双胍、丙戊酸钠缓释片。
对于难溶性原料药,需进行微粉化处理,控制原料粒径d90≤10μm,不影响制剂释放及体内吸收,如非洛地平、富马酸喹硫平缓释片。
步骤2:处理后的原料与一种或多种可以控制药物释放的低粘度亲水性多聚体物质湿法制粒,可含有适量的致孔剂、助溶剂、吸附剂等,制成均匀颗粒形成“内相”释放体系。
可控制药物释放的多聚体物质包括:黄原胶、羧甲基纤维素钠、阿拉伯胶、pva(聚乙烯醇)、明胶、羟丙基纤维素、hpmc(低粘度)。
常用致孔剂包括:微晶纤维素、乳糖等。
用量范围:原料与低粘度亲水性多聚体物质用量比例为2-10:1,对于难溶性药物需加入适量致孔剂,用量范围9%~20%(质量百分数),若需加入助溶剂,用量范围4.5%~15%(质量百分数)。
步骤3:将湿法制粒后颗粒与一种或多种可控制药物释放的高粘度亲水性多聚体物质混合均匀,可能包含适量的填充剂、助流剂、润滑剂等,经压片、包衣工艺后得该骨架型缓释制剂。
亲水凝胶型缓释辅料包括:hpmc、pvp(聚乙烯吡咯烷酮)、peg(聚乙二醇)等。
常用填充剂包括:微晶纤维素、玉米淀粉、预胶化淀粉、蔗糖、无机盐类、糖醇类物质等,改善药物的可压性。
用量范围:亲水性多聚体物质用量范围4%~45%(质量百分数),填充剂、润滑剂、助流剂用量为口服片剂的常用量即可,以保证压片过程顺利。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
实施例1大规格盐酸二甲双胍(易溶)缓释制剂(500mg)及其制备方法
临床上盐酸二甲双胍主要用于治疗单纯饮食控制不满意的ⅱ型糖尿病患者,尤其是肥胖和伴高胰岛素血症者,服用本药不但有降血糖作用,还可能有减轻体重和高胰岛素血症的效果。盐酸二甲双胍原料为白色结晶或结晶性粉末,水溶性较好,粒度较大,不能直接用于制剂工艺,普通片剂用药剂量较大,需多次服药以达到平稳的血药浓度,以确保临床有效性。
本实施例提供的盐酸二甲双胍缓释片,由缓释材料(包括羧甲纤维素钠7hf、hpmc-k100m、e5lv)、填充剂(微晶纤维素)、润滑剂(硬脂酸镁)组成,经湿法制粒工艺制得双层亲水的多聚体成型片系统(双相控制释放的缓释释放系统),经口服给药后24h内血药浓度平稳,具有抗高血糖的作用。且本品制剂工艺简单,适用于批量生产。
1、盐酸二甲双胍缓释片的成分如下(重量份):盐酸二甲双胍5份、微晶纤维素0.7份、羧甲纤维素钠(7hf)0.5份、hpmc(k100m)3.6份、hpmc(e5lv)0.1份和硬脂酸镁0.1份。
2、制备工艺:
步骤1:盐酸二甲双胍原料用万能粉碎机80~100目筛粉碎;
步骤2:将粉碎后的原料药与微晶纤维素和羧甲纤维素钠(7hf)在湿法制粒机中预混后,用适量润湿剂(纯化水或50%~75%乙醇水溶液)湿法制粒,60℃~70℃干燥,控制颗粒水分在2%以内,整粒成均匀的颗粒,为“内相”释放系统。
步骤3:将步骤2所得颗粒与hpmc(k100m)、hpmc(e5lv)和硬脂酸镁混合均匀,为“外相”释放系统,经压片工艺制得。
3、释放度考察
方法:进口药品注册标准,桨法,50转/min,1000ml脱气水为溶出介质,取样为供试品溶液,参照紫外-可见分光光度法(《中国药典》2015年版四部通则0401),在232nm波长处测定吸光度,计算溶出量。结果见表1和图1。
表1
对比例制备工艺:与实施例1相同的处方组成,将粉碎后的原料药与除硬脂酸镁外的辅料用纯化水湿法制粒,60~70℃干燥,与硬脂酸镁总混后,压片即得。
从该结果可知,实施例1制备的盐酸二甲双胍缓释片样品的体外溶出曲线释放平稳,24h充分释放药物,而传统湿法制粒工艺制备的二甲双胍缓释片前期释放较快,有突释的风险,故可以确定本发明制备工艺的可行性。
实施例2盐酸二甲双胍缓释片制备工艺对比
按照与实施例1相同的处方,采用cn1415288a具体实施方式一的制备工艺(即:将原料、辅料先50℃干燥6小时,均粉碎后过100目筛备用;然后,取盐酸二甲双胍5份、微晶纤维素0.7份、羧甲纤维素钠(7hf)0.5份、hpmc(k100m)3.6份、hpmc(e5lv)0.1份,按等量递增法充分混匀后,加入适量纯化水或50%~75%乙醇水溶液,制成软材,用18目筛制粒,50℃干燥2小时,取出,用18目筛整粒,加入硬脂酸镁0.1份混匀,然后用压片机压片,制成成药),并与实施例1的成药进行缓释效果比较。结果见表2和图2。
表2
本发明制得的成药缓释效果优于cn1415288a,释放更平缓,更利于临床使用,且本发明的制备工艺更简单,易于批量生产。
实施例3高粘度亲水性聚合物的种类、型号及用量的筛选试验
由于市售的羟丙基甲基纤维素有多种型号,本发明结合药物性质、临床用量及针对的适应症因素综合考虑,选用三种hpmc型号进行试验,以确定最佳方法。
分别取同等剂量的hpmce10m、hpmck15m、hpmck100m,按实施例1的制备工艺制备盐酸二甲双胍缓释片样品,在同等条件下测定体外累积释放度,考察缓释材料型号对盐酸二甲双胍缓释片体外释放曲线的影响。羟丙基甲基纤维素最佳型号筛选试验结果见表3和图3。
表3
实验结果表明,对于盐酸二甲双胍缓释片,选用hpmce10m、hpmck15m、hpmck100m作为缓释材料控制药物释放,所用缓释材料粘度越高,缓释效果越好,确定该制备工艺适用于高粘度型号的hpmc,优选hpmck100m。
实施例4小规格非洛地平(难溶)缓释制剂(10mg)及其制备方法
临床上非洛地平主要用于治疗高血压、稳定性心绞痛患者,对于高血压患者而言,服药具有依从性,需按时按点长期服用。
本实施例提供的非洛地平缓释片,由缓释材料(包括羟丙基纤维素-exf、hpmc-k100m、hpmc-e50)、致孔剂(无水乳糖)、填充剂(mcc)、润滑剂(硬脂富马酸钠)组成,经湿法制粒工艺制得一种亲水骨架型缓释片,该缓释片为双层亲水的多聚体成型片系统(双相控制释放的缓释释放系统),经口服给药后24h内血药浓度平稳,具有抗高血压的作用。
1、非洛地平缓释片的成分如下(重量份):非洛地平0.1份、无水乳糖0.3份、羟丙基纤维素(exf)0.3份、二氧化硅(0.15份)、聚氧乙烯蓖麻油(0.1份)、hpmck100m0.1份、hpmce500.8份、微晶纤维素0.3份和硬脂富马酸钠0.02份。
2、制备工艺:
步骤1:非洛地平原料进行微粉化处理,内控粒度范围d90<10μm。
步骤2:处理后的原料药与一种或多种可以控制药物释放的低粘度亲水性多聚体物质(如羟丙基纤维素)湿法制粒,含有适量致孔剂(无水乳糖)、助溶剂(聚氧乙烯蓖麻油),加入适量的二氧化硅制粒,用以改善物料的可压性,所得颗粒为“内相”释放系统。
具体工艺如下:将非洛地平原料0.1份、无水乳糖0.3份、羟丙基纤维素(exf)0.3份、二氧化硅(0.05份)和聚氧乙烯蓖麻油(0.1份)在湿法制粒机中预混后,用适量润湿剂(无水乙醇)湿法制粒,经干燥、整粒后制成颗粒均匀、色泽均一、无结块的颗粒。
步骤3:将湿法制粒后所得颗粒与一种或多种可控制药物释放的高粘度亲水性多聚体物质混合均匀,经压片、包衣工艺后制得该骨架型缓释制剂。
亲水凝胶型缓释辅料,如hpmc-k100m、hpmc-e50,加入适量填充剂、润滑剂、助流剂(利于压片工艺),制成“外相”释放系统。
具体工艺如下:将步骤2所得颗粒与hpmck100m0.1份、hpmce500.8份、微晶纤维素0.3份、二氧化硅0.1份和硬脂富马酸钠0.02份,混合均匀,压片,选用卡乐康的薄膜包衣预混剂(商品型号为03f630007-cn)进行包衣,增重在2%~4%范围内,得包衣片。
3、释放度考察
方法:usp40标准,桨法+固定篮,50转/min,500ml脱气水为溶出介质,按设定时间取样为供试品溶液,照高效液相色谱法(《中国药典》2015年版四部通则0512)测定,计算溶出量。结果见表4和图4。
表4
从该结果可知,实施例3制备的非洛地平缓释片样品的体外溶出曲线与市售非洛地平片plendil基本一致,本发明制备工艺释放更平稳,前期无突释风险,后期无释放不完全问题,由此确定本发明制备工艺的合理性。
实施例5羟丙基甲基纤维素型号的筛选试验
由于市售的羟丙基甲基纤维素有多种型号,本发明结合药物性质、临床用量及针对的适应症因素综合考虑,选用三种hpmc型号进行试验,以确定最佳方法。
分别取同等剂量的hpmce10m、hpmck15m、hpmck100m,按实施例4的制备工艺制备非洛地平缓释片样品,在同等条件下测定体外累积释放度,考察缓释材料型号对非洛地平缓释片体外释放曲线的影响。羟丙基甲基纤维素最佳型号筛选试验结果见表5和图5。
表5
实验结果表明,对于非洛地平缓释片,选用hpmce10m、hpmck15m、hpmck100m作为缓释材料控制药物释放无明显差别,该制备工艺适用于高粘度型号的hpmc。
实施例6与传统缓释片制备工艺的比较
将实施例4的制备工艺(非洛地平缓释片)与传统的未采用“双相”缓释系统的缓释制剂加工工艺进行比较,按照本发明工艺制得的缓释片剂的缓释效果更优,与对照制剂更接近。试验结果见表6和图6。
传统缓释制剂的加工工艺如下:与实施例4相同的处方组成,将原料与乳糖、微晶纤维素、羟丙基甲基纤维素等辅料加入湿法制粒机,用含4%~5%低取代hpmc的45%~50%的乙醇溶液制粒、干燥、整粒,再加入硬脂富马酸钠、二氧化硅总混后压片,包衣制得成品。
表6
本发明采用“双相”缓释系统制备缓释制剂,体外释放更平稳,缓释效果更佳,更有利于维持血药浓度稳定。
实施例7与粉末直压工艺的比较
取与实施例4相同处方组成的原辅料,非洛地平0.1份、无水乳糖0.3份、羟丙基纤维素(exf)0.3份、二氧化硅0.15份、聚氧乙烯蓖麻油0.1份、hpmck100m0.1份、hpmce500.8份、微晶纤维素0.3份混合20min,再加入硬脂富马酸钠0.02份混合5min,压片,选用卡乐康的薄膜包衣预混剂(商品型号为03f630007-cn)进行包衣,增重在2%~4%范围内,得包衣片。与实施例4的成药进行缓释效果比较,结果见表7和图7。
表7
通过以上比较可知,采用粉末直压工艺制备的缓释片剂,药物8h基本完全释放,缓释效果较差。
实施例8从处方中去除致孔剂所得非洛地平缓释片剂的缓释效果
按实施例4相同的制备工艺,去除处方中致孔剂无水乳糖,将制备的成药与实施例4进行缓释效果比较,结果见表8和图8。
处方组成:非洛地平0.1份、羟丙基纤维素(exf)0.3份、二氧化硅(0.15份)、聚氧乙烯蓖麻油(0.1份)、hpmck100m0.1份、hpmce500.8份、微晶纤维素0.3份和硬脂富马酸钠0.02份。
表8
通过以上比较可知,不添加致孔剂的处方,药物24h未完全释放,释放不完全,前期释放较慢,不利于血药浓度平稳。
实施例9富马酸喹硫平缓释制剂(50mg)及其制备方法
临床上富马酸喹硫平主要用于治疗精神分裂症。本实施例提供的富马酸喹硫平缓释片,由缓释材料(包括羟丙基纤维素-exf、hpmc-k100lv、hpmc-k4m)、致孔剂(乳糖)、填充剂(mcc)、ph调节剂(柠檬酸钠)、润滑剂(硬脂酸镁)组成,经湿法制粒工艺制得一种亲水骨架型缓释片,该缓释片为双层亲水的多聚体成型片系统(双相控制释放的缓释释放系统),经口服给药后24h内血药浓度平稳,具有抗精神分裂的作用。
取富马酸喹硫平5份、乳糖12.5份、柠檬酸钠3.5份、hpmc(k4m)2.5份加入湿法制粒机中混合均匀,用适量纯化水或75%乙醇制粒,50℃干燥至水分小于3%,取出,用40目筛整粒,加入微晶纤维素12.5份、hpmc(k100lv)12.5份混合10min,再加入硬脂酸镁0.5份混合5min,用压片机压片,用胃溶型薄膜包衣粉进行包衣,增重1%~3%,得成药。
按照上述相同的处方,取富马酸喹硫平5份、乳糖12.5份、柠檬酸钠3.5份、hpmc(k4m)2.5份、微晶纤维素12.5份、hpmc(k100lv)12.5份加入湿法制粒机中混合均匀后,用纯化水制软材,50℃烘干,水分小于3%,20目筛整粒,加入硬脂酸镁0.5份混合均匀,压片,用胃溶型薄膜包衣粉包衣,增重1%~3%,得成品即为传统工艺制得的富马酸喹硫平缓释片。与实施例9的缓释制剂进行缓释效果比较,结果见表9和图9。
表9
传统工艺制备的富马酸喹硫平24h未释放完全,本发明制备工艺所得缓释制剂24h释放完全,且释放较平稳,更利于临床使用。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
起点商标作为专业知识产权交易平台,可以帮助大家解决很多问题,如果大家想要了解更多知产交易信息请点击 【在线咨询】或添加微信 【19522093243】 与客服一对一沟通,为大家解决相关问题。
与客服一对一沟通,为大家解决相关问题。
此文章来源于网络,如有侵权,请联系删除
 热门咨询
热门咨询



 商标分类
商标分类  商标转让
商标转让 



